
Símbolo Ti.
Número atómico 22.
Densidad 4,45 kg/dm3.
Punto de fusión es de 1800°C.
Las propiedades mecánicas son similares, e incluso superiores, a las del acero, pero con la ventaja de que las conserva hasta los 400º C. Es muy resistente a la tracción y presenta gran tenacidad.
Obtención. Estado Natural
No se encuentra puro en la naturaleza. Constituye los minerales ilmenita (FeTiO3), rutilo (TiO2) y esfena (CaO • TiO2 • SiO2).
Para obtener el óxido de titanio se tritura el mineral y se mezcla con carbonato de potasio y ácido fluorhídrico produciendo fluorotitanato de potasio (K2TiF6). Éste se destila con agua caliente y se descompone con amoniaco. Así se obtiene óxido hidratado amoniacal, que se inflama en un recipiente de platino produciendo dióxido de titanio. Se trata el óxido con cloro, obteniéndose tetracloruro de titanio; que se reduce con magnesio para producir titanio metálico, que se funde y moldea en lingotes.
Aplicaciones
Es muy maleable y dúctil en caliente, debido a su resistencia y su densidad, el titanio se usa en aleaciones ligeras, aleado con aluminio y vanadio, se utiliza en aeronáutica para fabricar las puertas de incendios, el fuselaje, los componentes del tren de aterrizaje. Los cuadros de las bicicletas de carreras. Los álabes del compresor y los revestimientos de los motores a reacción.
Se usa ampliamente en misiles y cápsulas espaciales; las cápsulas Mercurio, Gemini y Apolo fueron construidas casi totalmente con titanio
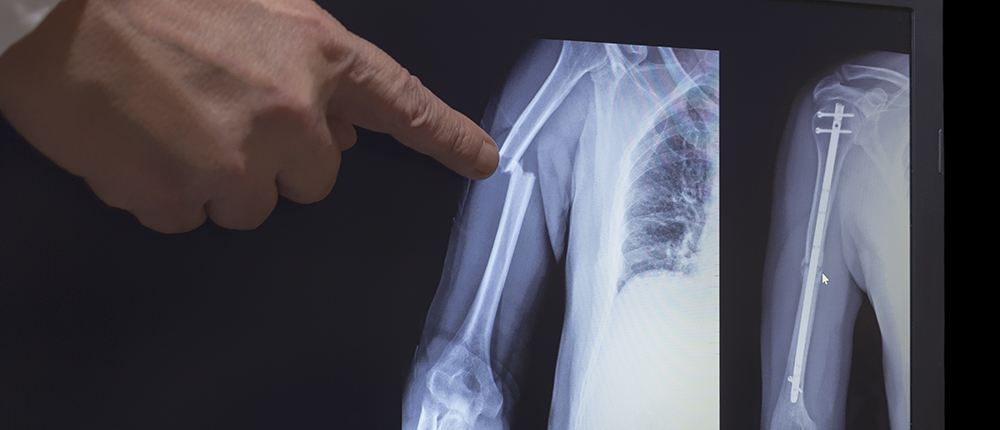
Es eficaz como sustituto de los huesos y cartílagos en cirugía. El Titanio es biocompatible, por ello se le emplea en herramientas quirúrgicas y en implantes médicos. También se integra a los huesos y es la estrella de la película en implantes dentales y ortopédicos que pueden tener una vida útil de hasta 30 años
Se usa en los intercambiadores de calor de las plantas de desalinización debido a su capacidad para soportar la corrosión del agua salada